Создать
Мой контент
Аккаунт
Каталог
Система
Приложение и соцсети
Правовая информация
Наши проекты
×
![]()
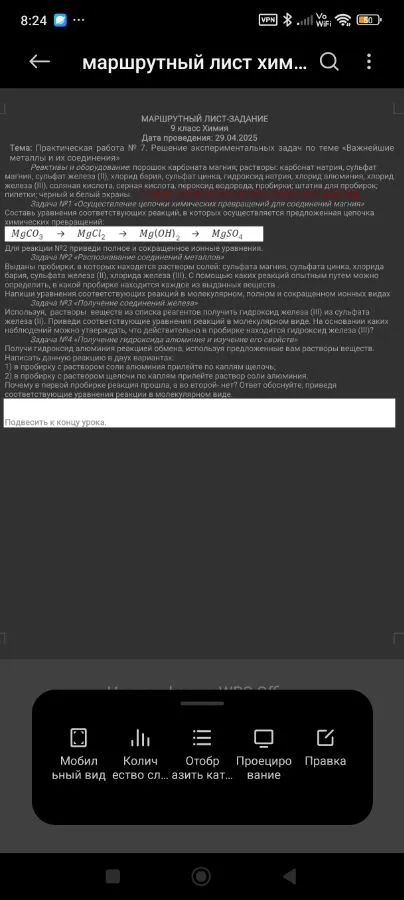
Необходимо составить уравнения реакций, соответствующие следующей цепочке превращений:
$\qquad \text{MgCO}_3 \rightarrow \text{MgCl}_2 \rightarrow \text{Mg(OH)}_2 \rightarrow \text{MgSO}_4$
Решение:
$\qquad \text{MgCO}_3 + 2\text{HCl} \rightarrow \text{MgCl}_2 + \text{H}_2\text{O} + \text{CO}_2 \uparrow$
Пояснение: Карбонат магния реагирует с соляной кислотой, образуя хлорид магния, воду и углекислый газ.
$\qquad \text{MgCl}_2 + 2\text{NaOH} \rightarrow \text{Mg(OH)}_2 \downarrow + 2\text{NaCl}$
Пояснение: Хлорид магния реагирует с гидроксидом натрия, образуя гидроксид магния (осадок) и хлорид натрия.
$\qquad \text{Mg(OH)}_2 + \text{H}_2\text{SO}_4 \rightarrow \text{MgSO}_4 + 2\text{H}_2\text{O}$
Пояснение: Гидроксид магния реагирует с серной кислотой, образуя сульфат магния и воду.
Вам выданы пробирки с растворами солей: сульфата магния, сульфата цинка, хлорида бария, сульфата железа(II), хлорида железа(III). Необходимо определить, в какой пробирке находится каждое из выданных веществ.
Решение:
Хлорид бария (BaCl2): Можно определить с помощью раствора серной кислоты (H2SO4). При добавлении серной кислоты к хлориду бария образуется белый осадок сульфата бария:
$\qquad \text{BaCl}_2 + \text{H}_2\text{SO}_4 \rightarrow \text{BaSO}_4 \downarrow + 2\text{HCl}$
Сульфат железа(II) (FeSO4) и хлорид железа(III) (FeCl3): Для их определения можно использовать роданид калия (KSCN).
$\qquad \text{FeCl}_3 + 3\text{KSCN} \rightleftharpoons \text{Fe(SCN)}_3 + 3\text{KCl}$
Сульфат магния (MgSO4) и сульфат цинка (ZnSO4): Для их определения можно использовать гидроксид натрия (NaOH).
$\qquad \text{MgSO}_4 + 2\text{NaOH} \rightarrow \text{Mg(OH)}_2 \downarrow + \text{Na}_2\text{SO}_4$
$\qquad \text{ZnSO}_4 + 2\text{NaOH} \rightarrow \text{Zn(OH)}_2 \downarrow + \text{Na}_2\text{SO}_4$
$\qquad \text{Zn(OH)}_2 + 2\text{NaOH} \rightarrow \text{Na}_2[\text{Zn(OH)}_4]$


Используйте Homiwork как обычное приложение. Это удобно!
Добавить на главный экранИспользуйте Homiwork как обычное приложение. Это удобно! Откройте меню Safari и нажмите 'Добавить на главный экран'.


Эта функция доступна только для пользователей с Прайм статусом
Высококачественные решения от нейросети с подробными объяснениями и визуализациями доступны эксклюзивно для пользователей с Прайм статусом.

Начав пользоваться сервисом, вы принимаете: Условия использования, Политика конфиденциальности, Политика возвратов
