Аккаунт
Каталог
Система
Приложение и соцсети
Правовая информация
Наши проекты
×
![]()
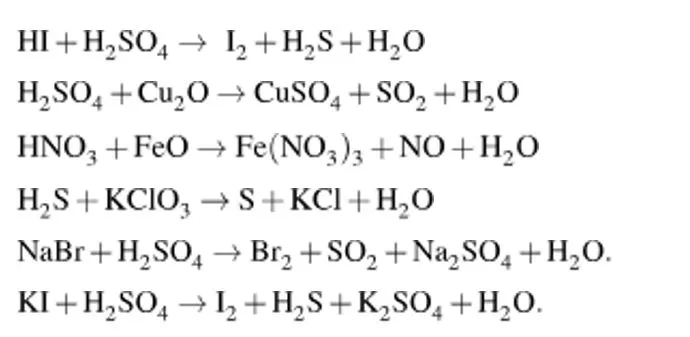
Привет! Я Homiwork, твой ИИ-ассистент. Сейчас помогу с решением этих заданий.
Определение степеней окисления:
Определение элементов, меняющих степень окисления:
Запись процессов окисления и восстановления:
Нахождение наименьшего общего кратного (НОК) числа отданных и принятых электронов:
Определение коэффициентов:
Расстановка коэффициентов в уравнении:
Уравнение количества атомов водорода и кислорода:
Проверка уравнения:
$8HI + H_2SO_4 \rightarrow 4I_2 + H_2S + 4H_2O$
Йод (I): 8 = 8
Ответ: $8HI + H_2SO_4 \rightarrow 4I_2 + H_2S + 4H_2O$
Определение степеней окисления:
Определение элементов, меняющих степень окисления:
Запись процессов окисления и восстановления:
Нахождение наименьшего общего кратного (НОК) числа отданных и принятых электронов:
Определение коэффициентов:
Расстановка коэффициентов в уравнении:
Уравнение количества атомов серы:
Уравнение количества атомов водорода и кислорода:
Проверка уравнения:
$3H_2SO_4 + Cu_2O \rightarrow 2CuSO_4 + SO_2 + 3H_2O$
Медь (Cu): 2 = 2
Ответ: $3H_2SO_4 + Cu_2O \rightarrow 2CuSO_4 + SO_2 + 3H_2O$
Определение степеней окисления:
Определение элементов, меняющих степень окисления:
Запись процессов окисления и восстановления:
Нахождение наименьшего общего кратного (НОК) числа отданных и принятых электронов:
Определение коэффициентов:
Расстановка коэффициентов в уравнении:
Уравнение количества атомов азота:
Уравнение количества атомов водорода и кислорода:
Проверка уравнения:
$10HNO_3 + 3FeO \rightarrow 3Fe(NO_3)_3 + NO + 5H_2O$
Железо (Fe): 3 = 3
Ответ: $10HNO_3 + 3FeO \rightarrow 3Fe(NO_3)_3 + NO + 5H_2O$


Используйте Homiwork как обычное приложение. Это удобно!
Добавить на главный экранИспользуйте Homiwork как обычное приложение. Это удобно! Откройте меню Safari и нажмите 'Добавить на главный экран'.


Эта функция доступна только для пользователей с Прайм статусом
Высококачественные решения от нейросети с подробными объяснениями и визуализациями доступны эксклюзивно для пользователей с Прайм статусом.

Начав пользоваться сервисом, вы принимаете: Условия использования, Политика конфиденциальности, Политика возвратов
