Создать
Мой контент
Аккаунт
Каталог
Система
Приложение и соцсети
Правовая информация
Наши проекты
×
![]()

Задание 1. Определение объекта с индивидуальным химическим веществом.
Рассмотрим каждый рисунок:
Рисунок 1: Канцелярская скрепка - это изделие из металлической проволоки, состоящее из смеси веществ (сплав металлов).
Рисунок 2: Молоко - это сложная смесь различных веществ (вода, белки, жиры, углеводы, минеральные вещества).
Рисунок 3: Кусок графита - это индивидуальное химическое вещество, состоящее из атомов углерода (C).
Ответ: На рисунке 3 изображён объект, содержащий индивидуальное химическое вещество - графит, кристаллическая форма углерода.
Задание 2. Определение веществ и их химических формул.
Рисунок 1 - Скрепка:
- Железо (Fe) - основной компонент стали
- Сталь является сплавом (смесью) железа с углеродом и другими элементами
Рисунок 2 - Молоко:
- Вода ($H_2O$) - основной компонент
- Содержит также белки, жиры, лактозу ($C_{12}H_{22}O_{11}$), минеральные вещества
Рисунок 3 - Графит:
- Чистый углерод (C)
- Является аллотропной модификацией углерода с слоистой кристаллической структурой
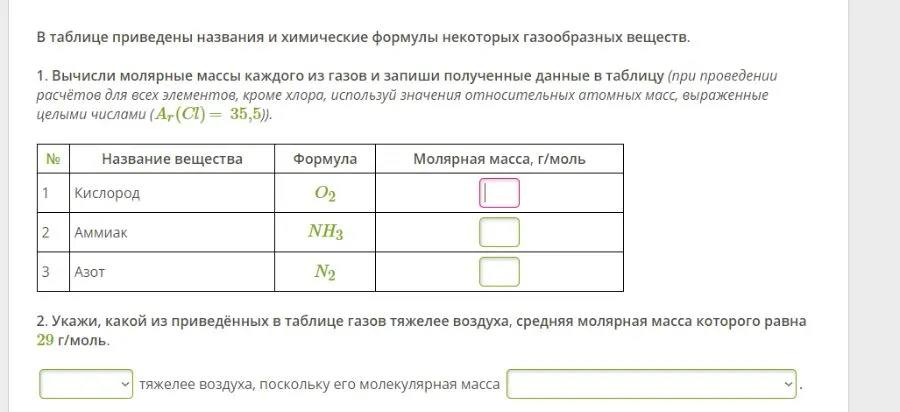
Задание 1. Вычисление молярных масс газов
Рассчитаем молярную массу каждого газа:
1) Кислород ($O_2$):
* Молярная масса $M(O_2) = 2 × 16 = 32$ г/моль
2) Аммиак ($NH_3$):
* Молярная масса $M(NH_3) = 14 + (3 × 1) = 17$ г/моль
3) Азот ($N_2$):
* Молярная масса $M(N_2) = 2 × 14 = 28$ г/моль
Таким образом, в таблицу следует записать:
* Кислород: 32 г/моль
* Аммиак: 17 г/моль
* Азот: 28 г/моль
Задание 2. Сравнение молярных масс газов с воздухом
Дано:
* Средняя молярная масса воздуха = 29 г/моль
Сравним молярные массы газов с воздухом:
* Кислород: 32 г/моль > 29 г/моль
* Аммиак: 17 г/моль < 29 г/моль
* Азот: 28 г/моль < 29 г/моль
Ответ: Кислород тяжелее воздуха, поскольку его молекулярная масса 32 г/моль больше, чем у воздуха (29 г/моль).


Используйте Homiwork как обычное приложение. Это удобно!
Добавить на главный экранИспользуйте Homiwork как обычное приложение. Это удобно! Откройте меню Safari и нажмите 'Добавить на главный экран'.


Эта функция доступна только для пользователей с Прайм статусом
Высококачественные решения от нейросети с подробными объяснениями и визуализациями доступны эксклюзивно для пользователей с Прайм статусом.

Начав пользоваться сервисом, вы принимаете: Условия использования, Политика конфиденциальности, Политика возвратов
