Создать
Мой контент
Аккаунт
Каталог
Система
Приложение и соцсети
Правовая информация
Наши проекты
×
![]()

📝 Задание 1
Дано:
$m_{р-ра(кон)} = 250 г$
$\omega_{(кон)} = 11,15 \%$
Найти:
$m_{(осадка)} - ?$
Решение:
Найдем массу вещества (кон) в растворе:
$m_{(кон)} = \frac{\omega_{(кон)} \cdot m_{р-ра(кон)}}{100 \%}$
$m_{(кон)} = \frac{11,15 \% \cdot 250 г}{100 \%} = 27,875 г$
Поскольку в условии не указано, что вещество (кон) выпадает в осадок не полностью, можно предположить, что масса осадка равна массе вещества (кон) в растворе.
Ответ: $m_{(осадка)} = 27,875 г$
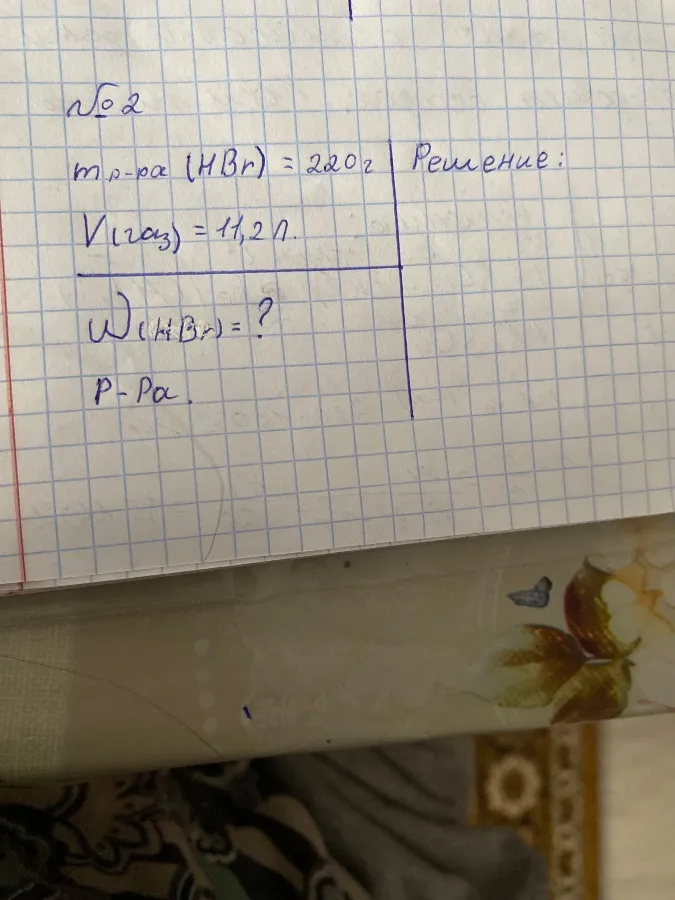
📝 Задание 2
Дано:
$m_{р-ра (HBr)} = 220 г$
$V_{(газа)} = 11,2 л$
Найти:
$\omega_{(HBr)} = ?$
Решение:
Запишем уравнение реакции между HBr и газом (предположим, что это газ $NH_3$):
$HBr + NH_3 = NH_4Br$
Найдем количество вещества газа $NH_3$:
$n_{(NH_3)} = \frac{V_{(NH_3)}}{V_m} = \frac{11,2 л}{22,4 л/моль} = 0,5 моль$
По уравнению реакции, количество вещества $HBr$ равно количеству вещества $NH_3$:
$n_{(HBr)} = n_{(NH_3)} = 0,5 моль$
Найдем массу $HBr$:
$M_{(HBr)} = 1 + 79,9 = 80,9 г/моль$
$m_{(HBr)} = n_{(HBr)} \cdot M_{(HBr)} = 0,5 моль \cdot 80,9 г/моль = 40,45 г$
Найдем массовую долю $HBr$ в растворе:
$\omega_{(HBr)} = \frac{m_{(HBr)}}{m_{р-ра (HBr)}} \cdot 100 \% = \frac{40,45 г}{220 г} \cdot 100 \% = 18,39 \%$
Ответ: $\omega_{(HBr)} = 18,39 \%$


Используйте Homiwork как обычное приложение. Это удобно!
Добавить на главный экранИспользуйте Homiwork как обычное приложение. Это удобно! Откройте меню Safari и нажмите 'Добавить на главный экран'.


Эта функция доступна только для пользователей с Прайм статусом
Высококачественные решения от нейросети с подробными объяснениями и визуализациями доступны эксклюзивно для пользователей с Прайм статусом.

Начав пользоваться сервисом, вы принимаете: Условия использования, Политика конфиденциальности, Политика возвратов
