Создать
Мой контент
Аккаунт
Каталог
Система
Приложение и соцсети
Правовая информация
Наши проекты
×
![]()

Химические реакции — это процессы превращения одних веществ в другие, сопровождающиеся изменением их состава и/или строения. В ходе химических реакций происходит разрыв одних химических связей и образование других, что приводит к появлению новых веществ с новыми свойствами.
Химические реакции можно распознать по следующим признакам:
- Изменение цвета
- Выделение или поглощение тепла (экзо- и эндотермические реакции)
- Образование осадка
- Выделение газа
- Появление или исчезновение запаха
- Свечение или появление пламени
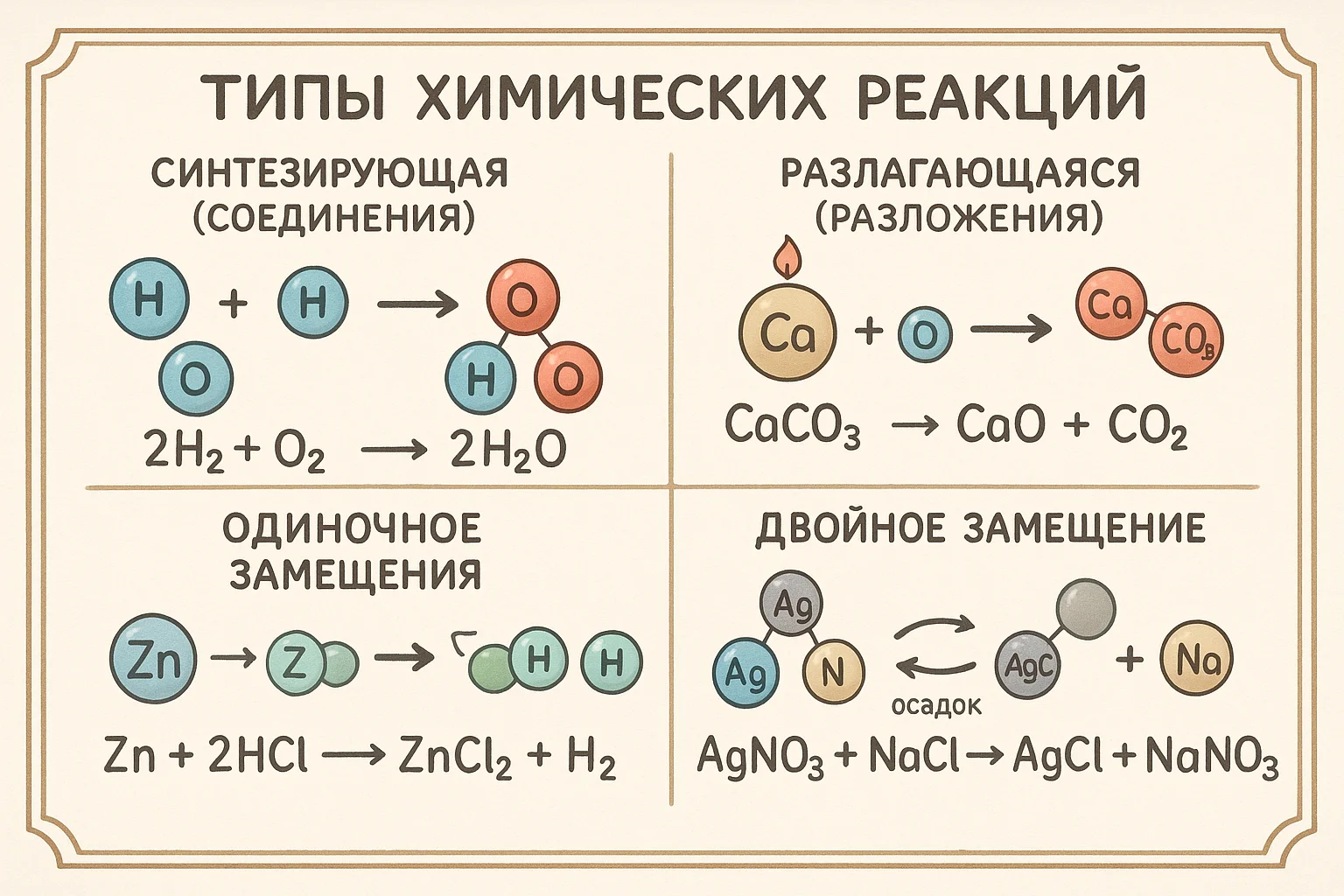
Реакции соединения: $A + B \rightarrow AB$
Пример: $2Mg + O_2 \rightarrow 2MgO$
Реакции разложения: $AB \rightarrow A + B$
Пример: $2H_2O_2 \rightarrow 2H_2O + O_2$
Реакции замещения: $A + BC \rightarrow AC + B$
Пример: $Zn + 2HCl \rightarrow ZnCl_2 + H_2$
Реакции обмена: $AB + CD \rightarrow AD + CB$
Пример: $AgNO_3 + NaCl \rightarrow AgCl + NaNO_3$
Окислительно-восстановительные реакции (ОВР): происходит изменение степеней окисления элементов.
Пример: $2KMnO_4 + 5Na_2SO_3 + 3H_2SO_4 \rightarrow 2MnSO_4 + 5Na_2SO_4 + K_2SO_4 + 3H_2O$
Не окислительно-восстановительные реакции: степени окисления элементов не изменяются.
Пример: $NaOH + HCl \rightarrow NaCl + H_2O$
Экзотермические реакции: выделяют тепло ($\Delta H < 0$).
Пример: $C + O_2 \rightarrow CO_2 + 393.5$ кДж
Эндотермические реакции: поглощают тепло ($\Delta H > 0$).
Пример: $N_2 + O_2 \rightarrow 2NO - 180.8$ кДж
Обратимые реакции: протекают одновременно в прямом и обратном направлениях.
Пример: $N_2 + 3H_2 \rightleftharpoons 2NH_3$
Необратимые реакции: протекают практически до конца в одном направлении.
Пример: $2Na + 2H_2O \rightarrow 2NaOH + H_2$
Каталитические реакции: протекают с участием катализатора.
Пример: $2SO_2 + O_2 \xrightarrow{V_2O_5} 2SO_3$
Некаталитические реакции: протекают без участия катализатора.
Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу времени:
$v = \frac{\Delta C}{\Delta t}$
Природа реагирующих веществ
- Реакции между ионами в растворах протекают быстрее
- Реакции с разрывом прочных связей протекают медленнее
Концентрация реагентов
- Закон действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении реакции.
- Для реакции $aA + bB \rightarrow cC + dD$: $v = k \cdot [A]^a \cdot [B]^b$
Температура
- Правило Вант-Гоффа: при повышении температуры на 10°C скорость реакции увеличивается в 2-4 раза.
- $v_{t+10} = v_t \cdot \gamma^1$, где $\gamma$ — температурный коэффициент (2-4)
Давление (для газообразных веществ)
- Повышение давления увеличивает скорость реакции, если она идет с уменьшением объема
Катализаторы
- Ускоряют реакцию, снижая энергию активации
- Не расходуются в процессе реакции
Площадь соприкосновения реагентов
- Измельчение твердых веществ увеличивает скорость реакции
Химическое равновесие — это состояние системы, при котором скорости прямой и обратной реакций равны.
Для обратимой реакции $aA + bB \rightleftharpoons cC + dD$ константа равновесия выражается формулой:
$K_c = \frac{[C]^c \cdot [D]^d}{[A]^a \cdot [B]^b}$
Если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится в сторону процесса, противодействующего этому воздействию.
Протекают в растворах электролитов и приводят к образованию малодиссоциирующих веществ (осадка, газа или воды).
Пример: $AgNO_3 + NaCl \rightarrow AgCl↓ + NaNO_3$
Полное ионное уравнение: $Ag^+ + NO_3^- + Na^+ + Cl^- \rightarrow AgCl↓ + Na^+ + NO_3^-$
Сокращенное ионное уравнение: $Ag^+ + Cl^- \rightarrow AgCl↓$
Взаимодействие ионов соли с водой, приводящее к образованию слабого электролита.
Гидролиз по катиону: соли слабых оснований и сильных кислот (NH₄Cl, FeCl₃)
$NH_4^+ + H_2O \rightleftharpoons NH_4OH + H^+$ (среда кислая)
Гидролиз по аниону: соли сильных оснований и слабых кислот (Na₂CO₃, CH₃COONa)
$CO_3^{2-} + H_2O \rightleftharpoons HCO_3^- + OH^-$ (среда щелочная)
Гидролиз по катиону и аниону: соли слабых оснований и слабых кислот (CH₃COONH₄)
Среда зависит от относительной силы кислоты и основания
Понимание типов химических реакций и факторов, влияющих на их протекание, является фундаментальным для успешного изучения химии и решения практических задач. Классификация реакций помогает предсказывать продукты реакций и условия их проведения.
Используйте Homiwork как обычное приложение. Это удобно!
Добавить на главный экранИспользуйте Homiwork как обычное приложение. Это удобно! Откройте меню Safari и нажмите 'Добавить на главный экран'.


Эта функция доступна только для пользователей с Прайм статусом
Высококачественные решения от нейросети с подробными объяснениями и визуализациями доступны эксклюзивно для пользователей с Прайм статусом.

Начав пользоваться сервисом, вы принимаете: Условия использования, Политика конфиденциальности, Политика возвратов
