Account
Catalogo
Sistema
App e Social
I Nostri Progetti
×
![]()
Okay, analizziamo e risolviamo il problema di chimica.
Lingua del compito: Italiano
Testo del problema:
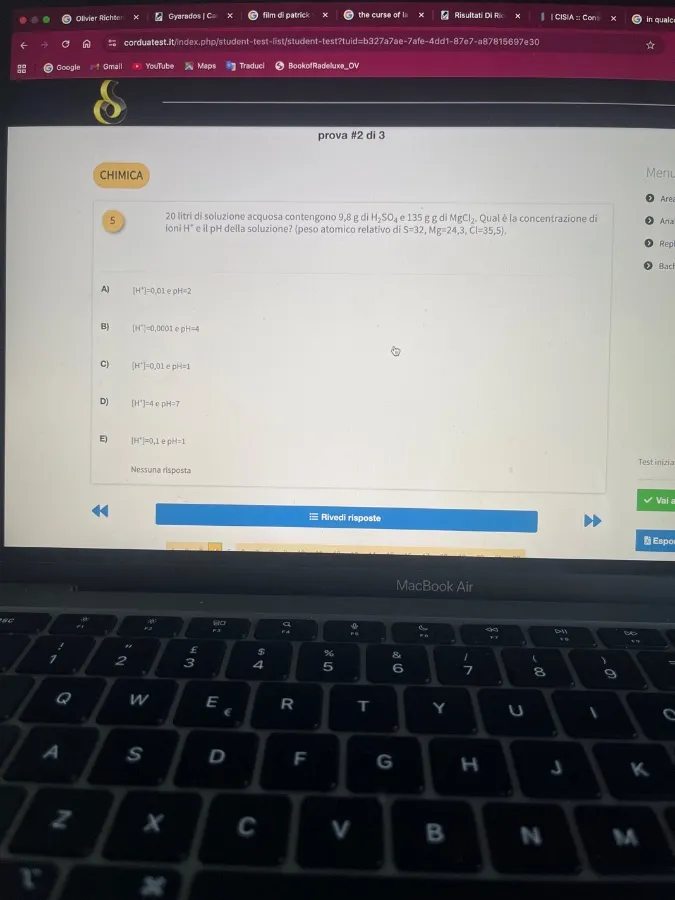
20 litri di soluzione acquosa contengono 9,8 g di H₂SO₄ e 135 g di MgCl₂. Qual è la concentrazione di ioni H⁺ e il pH della soluzione? (peso atomico relativo di S=32, Mg=24,3, Cl=35,5).
Soluzione:
Calcolare le moli di H₂SO₄:
Calcolare le moli di MgCl₂:
Calcolare la concentrazione di H⁺ derivante da H₂SO₄:
MgCl₂ non contribuisce alla concentrazione di H⁺.
Calcolare il pH:
Risposta:
[H⁺] = 0.01 M e pH = 2
Quindi, la risposta corretta è A) [H⁺] = 0,01 e pH = 2
Certo, posso spiegarti come trovare il pH senza usare direttamente la funzione logaritmo sulla calcolatrice.
Il pH è definito come il logaritmo negativo in base 10 della concentrazione degli ioni idrogeno (H⁺):
$pH = -log_{10}[H^+]$
Nel nostro caso, abbiamo calcolato che la concentrazione di H⁺ è 0.01 M. Possiamo esprimere 0.01 come una potenza di 10:
$0.01 = 10^{-2}$
Quindi, possiamo riscrivere la formula del pH come:
$pH = -log_{10}(10^{-2})$
Per la proprietà dei logaritmi, $log_{b}(b^x) = x$. In questo caso, $log_{10}(10^{-2}) = -2$.
Quindi,
$pH = -(-2) = 2$
In pratica, quando la concentrazione di H⁺ è una potenza di 10 (ad esempio, 0.1, 0.01, 0.001, ecc.), il pH è semplicemente l'esponente cambiato di segno.
E così via. Questo metodo funziona bene quando la concentrazione di H⁺ è una potenza intera di 10.
Risposta:
Il pH della soluzione è 2.
"L elevato a -1" si riferisce a $L^{-1}$, che è un modo per esprimere l'inverso di litri (L). In termini di unità di misura, $L^{-1}$ significa "per litro" o "inverso di litro".
Ad esempio, se hai una concentrazione espressa in moli per litro (mol/L), puoi anche scriverla come mol * $L^{-1}$ (mol * per litro).
Quindi, $L^{-1}$ è semplicemente un modo matematico per indicare che i litri sono al denominatore di una frazione o che si sta parlando di una quantità "per litro".


Usa Homiwork come un'app normale. È comoda!
Aggiungi alla schermata HomeUsa Homiwork come un'app normale. È comoda! Apri il menu di Safari e tocca 'Aggiungi alla schermata Home'.


Questa funzione è solo per gli utenti Prime
Soluzioni AI di alta qualità con spiegazioni dettagliate e visualizzazioni sono disponibili esclusivamente per gli utenti Prime.

Iniziando a usare il servizio, accetti: Termini di Servizio, Politica sulla Privacy, Politica di Rimborso
