Cuenta
Catálogo
Ajustes
Sistema
App y Redes Sociales
Nuestros Proyectos
×
![]()
¡Hola! Vamos a resolver los problemas paso a paso.
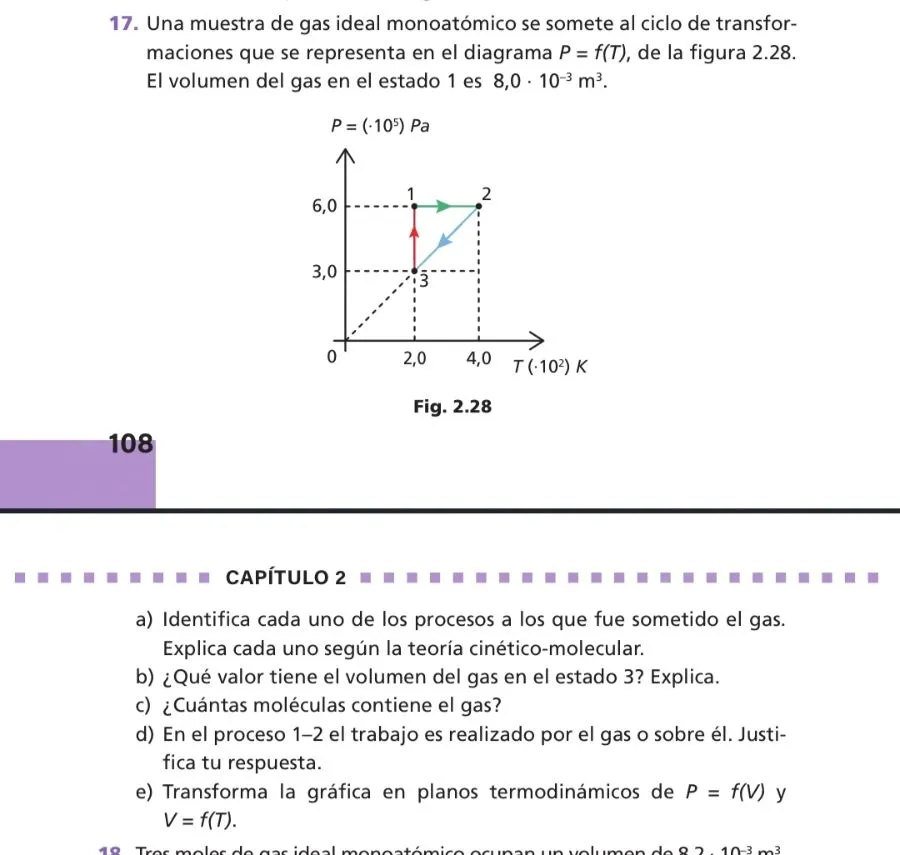
Identifica cada uno de los procesos a los que fue sometido el gas. Explica cada uno según la teoría cinético-molecular.
Proceso 1-2: Este proceso ocurre a presión constante (isobárico). La temperatura aumenta de 2.0 x 10² K a 4.0 x 10² K. Según la teoría cinético-molecular, al aumentar la temperatura, las moléculas del gas se mueven más rápido, lo que implica un aumento en la energía cinética promedio de las moléculas. Dado que la presión es constante, el volumen debe aumentar para mantener la relación de la ley de los gases ideales.
Proceso 2-3: Este proceso ocurre con una relación lineal entre la presión y la temperatura que pasa por el origen. Esto indica que el volumen es constante (isocórico). La presión disminuye de 6.0 x 10⁵ Pa a 3.0 x 10⁵ Pa, y la temperatura disminuye de 4.0 x 10² K a 2.0 x 10² K. Según la teoría cinético-molecular, la disminución de la presión y la temperatura implica que las moléculas del gas se mueven más lentamente y chocan con menos fuerza contra las paredes del recipiente, pero el número de colisiones por unidad de tiempo es constante debido al volumen constante.
Proceso 3-1: Este proceso ocurre a temperatura constante (isotérmico). La presión aumenta de 3.0 x 10⁵ Pa a 6.0 x 10⁵ Pa. Según la teoría cinético-molecular, a temperatura constante, la energía cinética promedio de las moléculas permanece constante. Al aumentar la presión, el volumen debe disminuir, lo que implica que las moléculas están más cerca unas de otras y chocan con mayor frecuencia contra las paredes del recipiente.
¿Qué valor tiene el volumen del gas en el estado 3? Explica.
Para encontrar el volumen en el estado 3, podemos usar la ley de los gases ideales:
$PV = nRT$
Primero, necesitamos encontrar el número de moles ($n$) del gas. Podemos usar la información del estado 1:
$n = \frac{P_1V_1}{RT_1} = \frac{(6.0 \times 10^5 \, \text{Pa})(8.0 \times 10^{-3} \, \text{m}^3)}{(8.314 \, \text{J/(mol K)})(2.0 \times 10^2 \, \text{K})} \approx 2.886 \, \text{mol}$
Ahora, podemos encontrar el volumen en el estado 3:
$V_3 = \frac{nRT_3}{P_3} = \frac{(2.886 \, \text{mol})(8.314 \, \text{J/(mol K)})(2.0 \times 10^2 \, \text{K})}{3.0 \times 10^5 \, \text{Pa}} \approx 1.6 \times 10^{-2} \, \text{m}^3$
¿Cuántas moléculas contiene el gas?
Para encontrar el número de moléculas, podemos usar el número de moles ($n$) que calculamos en el paso anterior y el número de Avogadro ($N_A = 6.022 \times 10^{23} \, \text{mol}^{-1}$):
Número de moléculas $= n \times N_A = 2.886 \, \text{mol} \times 6.022 \times 10^{23} \, \text{mol}^{-1} \approx 1.738 \times 10^{24} \, \text{moléculas}$
Respuestas:


Usa Homiwork como una app regular. ¡Es conveniente!
Agregar a la pantalla de inicioUsa Homiwork como una app regular. ¡Es conveniente!. Abre tu menú Safari y toca 'Agregar a la pantalla de inicio'.


Esta función es solo para usuarios Prime
Las soluciones de IA de alta calidad con explicaciones detalladas y visualizaciones están disponibles exclusivamente para los usuarios Prime.

Al comenzar a usar el servicio, aceptas: Términos del servicio, Política de privacidad, Política de reembolso
