Identificación de carbonos primarios, secundarios, terciarios y cuaternarios en estructuras orgánicas
¡Hola! Vamos a resolver este ejercicio de química orgánica paso a paso.
Identificación del idioma: El idioma del texto es español.
Tarea: Identificar y señalar los carbonos primarios, secundarios, terciarios y cuaternarios en las estructuras dadas, de acuerdo con la numeración proporcionada.
Задание 1
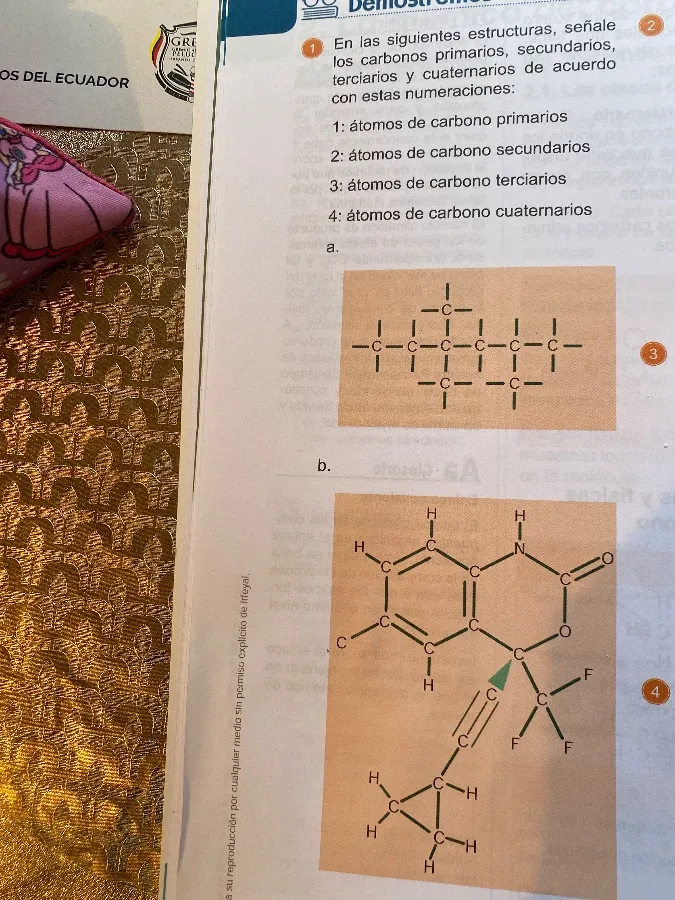
Estructura a:
Primero, vamos a analizar la estructura a. Un átomo de carbono se clasifica según el número de otros átomos de carbono a los que está unido:
- Primario (1°): Unido a un solo átomo de carbono.
- Secundario (2°): Unido a dos átomos de carbono.
- Terciario (3°): Unido a tres átomos de carbono.
- Cuaternario (4°): Unido a cuatro átomos de carbono.
En la estructura a:
- Átomos de carbono primarios (1): Son los que están en los extremos de las cadenas y solo están unidos a un carbono. Hay 8 átomos de carbono primarios.
- Átomos de carbono secundarios (2): Son los que están unidos a dos carbonos. Hay 4 átomos de carbono secundarios.
- Átomos de carbono cuaternarios (4): Es el carbono central que está unido a cuatro carbonos. Hay 1 átomo de carbono cuaternario.
- Átomos de carbono terciarios (3): No hay átomos de carbono terciarios en esta estructura.
Задание 2
Estructura b:
Ahora, analicemos la estructura b. Esta estructura es más compleja y contiene un anillo aromático y otros grupos funcionales.
- Átomos de carbono primarios (1): Son los que están en los extremos de las cadenas y solo están unidos a un carbono. Hay 3 átomos de carbono primarios (los que tienen los tres hidrógenos).
- Átomos de carbono secundarios (2): Son los que están unidos a dos carbonos. Hay 4 átomos de carbono secundarios (dos en el cicloalcano y dos en la cadena alifática).
- Átomos de carbono terciarios (3): Son los que están unidos a tres carbonos. Hay 4 átomos de carbono terciarios (tres en el anillo aromático y uno en el cicloalcano).
- Átomos de carbono cuaternarios (4): Son los que están unidos a cuatro carbonos. Hay 3 átomos de carbono cuaternarios (dos en el anillo aromático y uno central unido a los dos fluoros).
¡Hola! Vamos a continuar resolviendo los ejercicios de química orgánica.
Задание 3
Ejercicio 5:
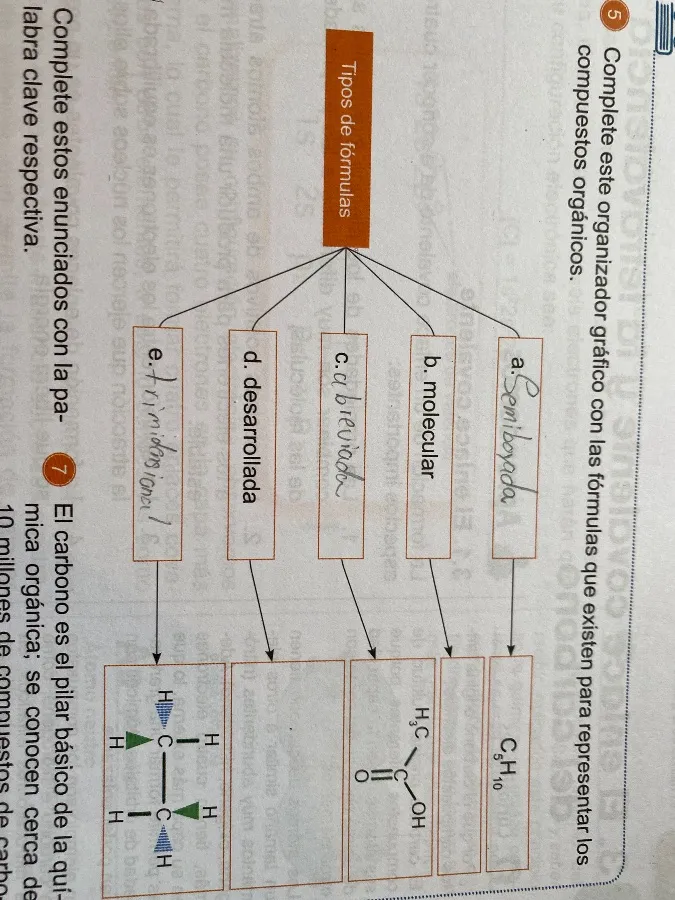
Completa el organizador gráfico con las fórmulas que existen para representar los compuestos orgánicos.
Aquí están los tipos de fórmulas y sus descripciones:
- a. Semidesarrollada: Muestra los grupos de átomos unidos a cada carbono, pero no todos los enlaces. Ejemplo: $CH_3CH_2OH$.
- b. Molecular: Indica el número total de átomos de cada elemento en la molécula. Ejemplo: $C_4H_{10}$.
- c. Abreviada: Representa la estructura de forma simplificada, como fórmulas de esqueleto donde los carbonos e hidrógenos no se muestran explícitamente.
- d. Desarrollada: Muestra todos los átomos y enlaces en la molécula.
- e. Tridimensional: Representa la estructura en el espacio, mostrando la disposición tridimensional de los átomos.
Задание 4
Ejercicio 7:
Completa estos enunciados con la palabra clave respectiva.
- "El carbono es el pilar básico de la química orgánica; se conocen cerca de 10 millones de compuestos de carbono."
La palabra clave aquí es carbono.

¡Hola! Vamos a continuar con los ejercicios.
Задание 5
Ejercicio 1:
A continuación se presentan algunas proposiciones respecto al enlace covalente. Escribe verdadero (V) o falso (F) según corresponda.
-
a. A los enlaces covalentes se los representa mediante estructuras de Lewis que señalan los electrones compartidos.
Respuesta: Verdadero (V). Las estructuras de Lewis son representaciones que muestran cómo se comparten los electrones en los enlaces covalentes.
-
b. Los núcleos positivos de los dos átomos atraen a los electrones para producir una molécula más estable.
Respuesta: Verdadero (V). La atracción electrostática entre los núcleos positivos y los electrones compartidos es lo que mantiene unidos a los átomos en un enlace covalente.
-
c. Los compuestos orgánicos poseen en su mayoría enlaces de tipo covalente.
Respuesta: Verdadero (V). Los compuestos orgánicos están formados principalmente por carbono e hidrógeno, que forman enlaces covalentes entre sí.
-
d. La formación de enlaces covalentes es un proceso que necesita energía.
Respuesta: Falso (F). La formación de enlaces covalentes generalmente libera energía (es un proceso exotérmico), mientras que romper enlaces requiere energía (es un proceso endotérmico).
Ассистент: ¡Hola! Vamos a continuar con los ejercicios.
Задание 6
Ejercicio 2:
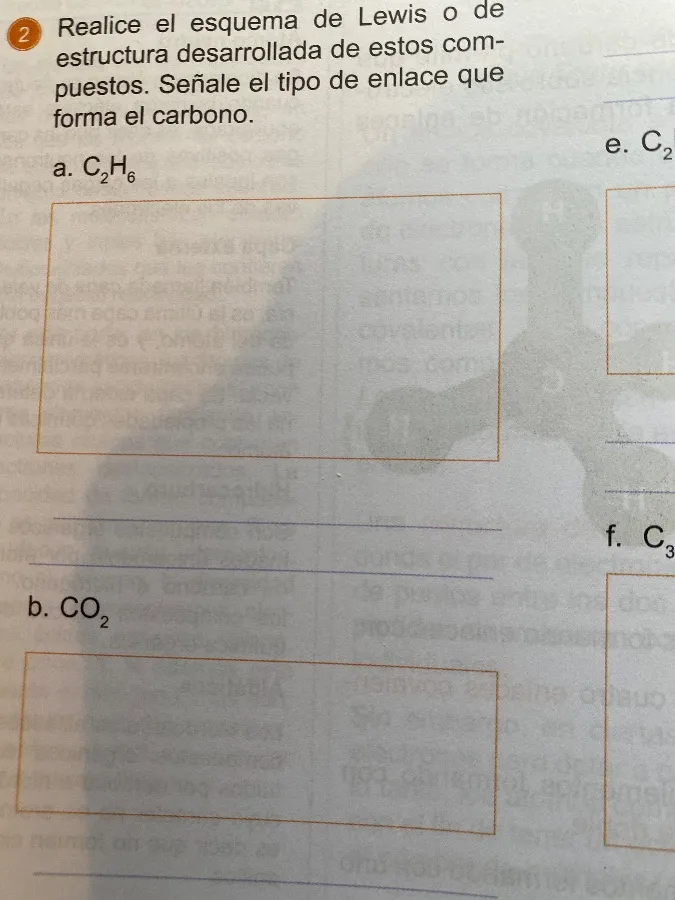
Realice el esquema de Lewis o de estructura desarrollada de estos compuestos. Señale el tipo de enlace que forma el carbono.
a. $C_2H_6$ (Etano)
- Estructura de Lewis/Desarrollada:
H H
| |
H - C - C - H
| |
H H
- Tipo de enlace: Enlaces covalentes simples (C-H y C-C).
b. $CO_2$ (Dióxido de carbono)
- Estructura de Lewis/Desarrollada:
O = C = O
- Tipo de enlace: Enlaces covalentes dobles (C=O).
e. $C_2H_4$ (Eteno)
- Estructura de Lewis/Desarrollada:
H H
| |
H - C = C - H
- Tipo de enlace: Un enlace covalente doble (C=C) y enlaces covalentes simples (C-H).
f. $C_3H_8$ (Propano)
- Estructura de Lewis/Desarrollada:
H H H
| | |
H - C - C - C - H
| | |
H H H
- Tipo de enlace: Enlaces covalentes simples (C-H y C-C).

Ассистент: ¡Hola! Vamos a continuar con los ejercicios.
Задание 7
Ejercicio 2:
Realice el esquema de Lewis o de estructura desarrollada de estos compuestos. Señale el tipo de enlace que forma el carbono.
c. $C_2H_2$ (Etino)
- Estructura de Lewis/Desarrollada:
H - C ≡ C - H
- Tipo de enlace: Un enlace covalente triple (C≡C) y enlaces covalentes simples (C-H).
d. $CH_4$ (Metano)
- Estructura de Lewis/Desarrollada:
H
|
H - C - H
|
H
- Tipo de enlace: Enlaces covalentes simples (C-H).

¡Hola! Vamos a continuar resolviendo los ejercicios de química orgánica paso a paso.
Задание 8
Ejercicio 3:
Complete la configuración electrónica del carbono.
La configuración electrónica del carbono (C) es:
$[C] = 1s^2 2s^2 2p^2$
Задание 9
Ejercicio 4:
¿Por qué el carbono es el elemento que presenta el mayor número de compuestos?
El carbono es el elemento que presenta el mayor número de compuestos debido a las siguientes razones:
- Tetravalencia: El carbono tiene cuatro electrones de valencia, lo que le permite formar cuatro enlaces covalentes con otros átomos.
- Capacidad de formar cadenas: El carbono puede unirse a otros átomos de carbono para formar cadenas largas y anillos, lo que aumenta la diversidad de compuestos.
- Formación de enlaces múltiples: El carbono puede formar enlaces simples, dobles y triples, lo que también contribuye a la variedad de compuestos.
Задание 10
Ejercicio 5:
¿De qué sirve que el carbono tenga un tamaño pequeño?
El tamaño pequeño del carbono permite que los enlaces que forma sean fuertes y estables. Esto se debe a que los electrones de enlace están más cerca del núcleo, lo que aumenta la atracción electrostática y la estabilidad del enlace.





