मेरी सामग्री
खाता
कैटलॉग
सिस्टम
ऐप और सोशल
हमारे प्रोजेक्ट्स
×
![]()

Химические реакции — это процессы превращения одних веществ в другие, сопровождающиеся изменением их состава и/или строения. В ходе химических реакций происходит разрыв одних химических связей и образование других, что приводит к появлению новых веществ с новыми свойствами.
Химические реакции можно распознать по следующим признакам:
- Изменение цвета
- Выделение или поглощение тепла (экзо- и эндотермические реакции)
- Образование осадка
- Выделение газа
- Появление или исчезновение запаха
- Свечение или появление пламени
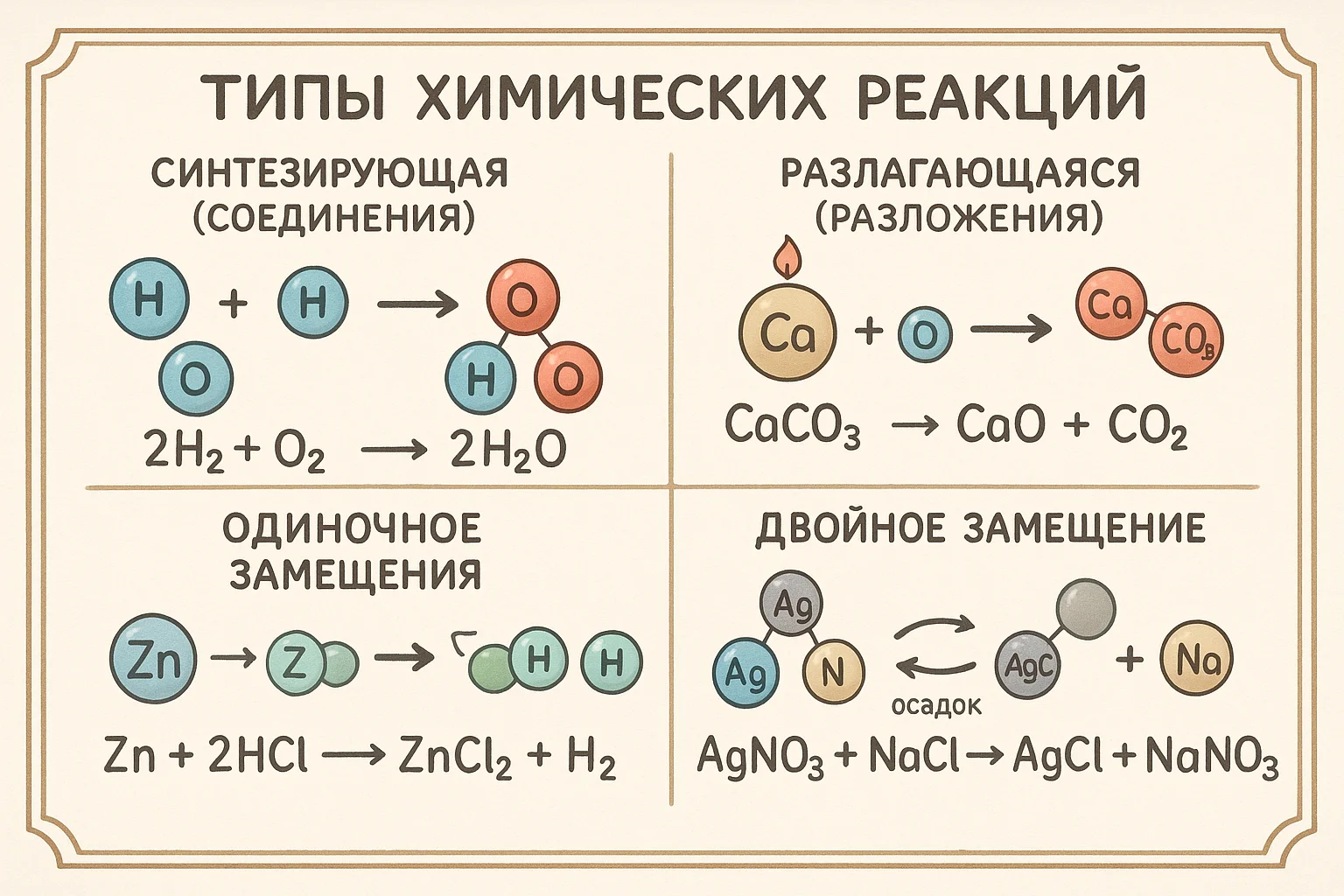
Реакции соединения: $A + B \rightarrow AB$
Пример: $2Mg + O_2 \rightarrow 2MgO$
Реакции разложения: $AB \rightarrow A + B$
Пример: $2H_2O_2 \rightarrow 2H_2O + O_2$
Реакции замещения: $A + BC \rightarrow AC + B$
Пример: $Zn + 2HCl \rightarrow ZnCl_2 + H_2$
Реакции обмена: $AB + CD \rightarrow AD + CB$
Пример: $AgNO_3 + NaCl \rightarrow AgCl + NaNO_3$
Окислительно-восстановительные реакции (ОВР): происходит изменение степеней окисления элементов.
Пример: $2KMnO_4 + 5Na_2SO_3 + 3H_2SO_4 \rightarrow 2MnSO_4 + 5Na_2SO_4 + K_2SO_4 + 3H_2O$
Не окислительно-восстановительные реакции: степени окисления элементов не изменяются.
Пример: $NaOH + HCl \rightarrow NaCl + H_2O$
Экзотермические реакции: выделяют тепло ($\Delta H < 0$).
Пример: $C + O_2 \rightarrow CO_2 + 393.5$ кДж
Эндотермические реакции: поглощают тепло ($\Delta H > 0$).
Пример: $N_2 + O_2 \rightarrow 2NO - 180.8$ кДж
Обратимые реакции: протекают одновременно в прямом и обратном направлениях.
Пример: $N_2 + 3H_2 \rightleftharpoons 2NH_3$
Необратимые реакции: протекают практически до конца в одном направлении.
Пример: $2Na + 2H_2O \rightarrow 2NaOH + H_2$
Каталитические реакции: протекают с участием катализатора.
Пример: $2SO_2 + O_2 \xrightarrow{V_2O_5} 2SO_3$
Некаталитические реакции: протекают без участия катализатора.
Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу времени:
$v = \frac{\Delta C}{\Delta t}$
Природа реагирующих веществ
- Реакции между ионами в растворах протекают быстрее
- Реакции с разрывом прочных связей протекают медленнее
Концентрация реагентов
- Закон действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении реакции.
- Для реакции $aA + bB \rightarrow cC + dD$: $v = k \cdot [A]^a \cdot [B]^b$
Температура
- Правило Вант-Гоффа: при повышении температуры на 10°C скорость реакции увеличивается в 2-4 раза.
- $v_{t+10} = v_t \cdot \gamma^1$, где $\gamma$ — температурный коэффициент (2-4)
Давление (для газообразных веществ)
- Повышение давления увеличивает скорость реакции, если она идет с уменьшением объема
Катализаторы
- Ускоряют реакцию, снижая энергию активации
- Не расходуются в процессе реакции
Площадь соприкосновения реагентов
- Измельчение твердых веществ увеличивает скорость реакции
Химическое равновесие — это состояние системы, при котором скорости прямой и обратной реакций равны.
Для обратимой реакции $aA + bB \rightleftharpoons cC + dD$ константа равновесия выражается формулой:
$K_c = \frac{[C]^c \cdot [D]^d}{[A]^a \cdot [B]^b}$
Если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится в сторону процесса, противодействующего этому воздействию.
Протекают в растворах электролитов и приводят к образованию малодиссоциирующих веществ (осадка, газа или воды).
Пример: $AgNO_3 + NaCl \rightarrow AgCl↓ + NaNO_3$
Полное ионное уравнение: $Ag^+ + NO_3^- + Na^+ + Cl^- \rightarrow AgCl↓ + Na^+ + NO_3^-$
Сокращенное ионное уравнение: $Ag^+ + Cl^- \rightarrow AgCl↓$
Взаимодействие ионов соли с водой, приводящее к образованию слабого электролита.
Гидролиз по катиону: соли слабых оснований и сильных кислот (NH₄Cl, FeCl₃)
$NH_4^+ + H_2O \rightleftharpoons NH_4OH + H^+$ (среда кислая)
Гидролиз по аниону: соли сильных оснований и слабых кислот (Na₂CO₃, CH₃COONa)
$CO_3^{2-} + H_2O \rightleftharpoons HCO_3^- + OH^-$ (среда щелочная)
Гидролиз по катиону и аниону: соли слабых оснований и слабых кислот (CH₃COONH₄)
Среда зависит от относительной силы кислоты и основания
Понимание типов химических реакций и факторов, влияющих на их протекание, является фундаментальным для успешного изучения химии и решения практических задач. Классификация реакций помогает предсказывать продукты реакций и условия их проведения.
Homiwork का उपयोग नियमित ऐप के रूप में करें। यह सुविधाजनक है!
होम स्क्रीन में जोड़ेंHomiwork का उपयोग नियमित ऐप के रूप में करें। यह सुविधाजनक है!. अपने सफारी मेनू को खोलें और 'होम स्क्रीन में जोड़ें' पर टैप करें।


यह सुविधा केवल Prime उपयोगकर्ताओं के लिए है
विस्तृत स्पष्टीकरण और विज़ुअलाइज़ेशन के साथ उच्च-गुणवत्ता वाले AI समाधान विशेष रूप से Prime उपयोगकर्ताओं के लिए उपलब्ध हैं।

सेवा का उपयोग शुरू करके, आप स्वीकार करते हैं: सेवा की शर्तें, गोपनीयता नीति, रिफंड नीति
